Translate
viernes, 30 de agosto de 2019
viernes, 23 de agosto de 2019
jueves, 8 de agosto de 2019
Semana #26
Reacciones Organicas:
Debido a la enorme cantidad y diversidad existente de compuestos orgánicos, se hace comprensible que las reacciones que tienen lugar entre ellos sean también bastante variadas. Sin embargo, las reacciones pueden encontrarse clasificadas en unos pocos grupos principales, pero para conocerlos primero debemos saber las formas de ruptura que tienen lugar en los enlaces, así como las clases de reactivos que pueden verse involucrados en las reacciones.
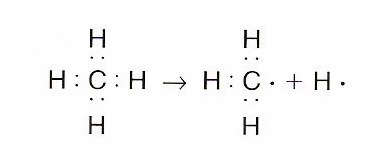
Debido a la enorme cantidad y diversidad existente de compuestos orgánicos, se hace comprensible que las reacciones que tienen lugar entre ellos sean también bastante variadas. Sin embargo, las reacciones pueden encontrarse clasificadas en unos pocos grupos principales, pero para conocerlos primero debemos saber las formas de ruptura que tienen lugar en los enlaces, así como las clases de reactivos que pueden verse involucrados en las reacciones.
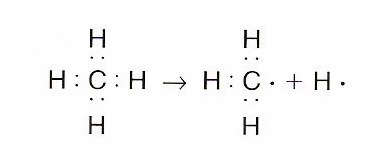
Ruptura de enlaces:
Las reacciones suponen que se lleve a cabo una ruptura de alguno de los enlaces que intervienen en las moléculas de las sustancias que reaccionan y la reordenación de los electrones de valencia para formar nuevos enlaces en los productos que da la reacción. Dichas rupturas, por lo general, pueden ocurrir en dos formas: ruptura hemolítica, y ruptura heterolítica.
Ruptura homolítica: Tiene lugar cuando un enlace de tipo covalente A:B se ve roto de manera que cada uno de los átomos se queda con un electrón del par del enlace. De esta manera, se consiguen dos radicales libres.
Dichas especies son neutras eléctricamente hablando, poseen un electrón que se encuentra desapareado, son bastante reactivas y cuentan con una vida media bastante corta.
La ruptura del enlace A:B tiene lugar así:
AB → A: + B∙
Ejemplo:
Este tipo de ruptura suele darse en compuestos que cuentan con una baja o incluso nula, polaridad y necesitan un suministro de energía que corresponda con la disociación del enlace.
Por esto, para poder iniciar la reacción a través de radicales libres se necesita un alto aporte a nivel energético. Dicha aportación puede llevarse a cabo a través de una vía térmica o también siguiendo un suministro de radiaciones. Estas reacciones generalmente tienen lugar en fase o estado gaseoso, o encontrándose en disolución con disolventes que sean no polares.
Ruptura heterolítica:
Se realiza cuando el enlace covalente A:B se rompe de maera que uno de los dos átomos que forma en enlace se quede con el par de electrones de este. De esta manera se consiguen dos iones, uno será positivo y el otro negativo.
La ruptura del enlace A:B se sucede así :
A:B → A+ + :B-
Ejemplo:
A:B → A+ + :B-
Ejemplo:
Cuando un carbono consigue conservar los dos electrones, el ion resultante recibe el nombre de carbanión R-, y en cambio, cuando los pierde se le denomina carbocatión R+. Es más frecuente la formación de un carbocatión que de un carboanión.
La ruptura heterolítica en un enlace covalente tiende a producirse en moléculas con una gran polaridad. Esta ruptura tiene lugar en condiciones más suaves que la ruptura homolítica, y por lo general, se da en presencia de disolventes polares que consiguen estabilizar a los iones.
Ya sean los radicales libres formados a partir de la ruptura homolítica como los iones que se dan en la ruptura heterolítica, reciben ambos el nombre de intermedios de reacción, e intervienen de manera general en los mecanismos de las reacciones de tipo orgánicas a modo de reactivos intermedios.
Clases de reactivos:
Es normal en las reacciones de la química orgánica llamar sustrato y reactivo a las distintas sustancias que participan en las reacciones. La molécula que reacciona, generalmente es la mayor, y se llama sustrato. Esta será atacada por otra molécula, por lo general más pequeña, llamada reactivo, que dará lugar a la reacción química al interaccionar con el sustrato. Dicho reactivo, puede ser de distintas naturalezas, inorgánico, radical libre, electrófilo o nucleófilo.
– Radicales libres: se producen en las reacciones homolíticas, son bastante reactivos e interaccionan con otros tipos de radicales o con moléculas de tipo neutro. Los radicales en química orgánica se llaman primarios, secundarios o terciarios, dependiendo de la naturaleza que tenga el carbono que cuente con el electrón no apareado. Los radicales terciarios son los que mças estabilidad poseen, y por lo tanto, son menos reactivos.
– Reactivos electrófilos: Son reactivos con alguno de sus átomos de poca densidad electrónica, por lo cual suelen actuar sobre los átomos del sustrato que tienen carga negativa, o una alta densidad de carga. Los reactivos electrófilos siempre son cationes u otras moléculas que tienen algún orbital atómico sin ocupar, como por ejemplo H+, BF3, SO3, etc.
– Reactivos nucleófilos: Son reactivos que tienen algunos de sus átomos con una alta densidad de carga, por lo que suelen actuar en los átomos del sustrato que tenfa carga positiva o un deficit de carga. Por lo general son aniones o neutros con electrones libres, por lo tanto, ceden electrones. Es el caso del H-, OH-, CN-, etc.
– Reactivos electrófilos: Son reactivos con alguno de sus átomos de poca densidad electrónica, por lo cual suelen actuar sobre los átomos del sustrato que tienen carga negativa, o una alta densidad de carga. Los reactivos electrófilos siempre son cationes u otras moléculas que tienen algún orbital atómico sin ocupar, como por ejemplo H+, BF3, SO3, etc.
– Reactivos nucleófilos: Son reactivos que tienen algunos de sus átomos con una alta densidad de carga, por lo que suelen actuar en los átomos del sustrato que tenfa carga positiva o un deficit de carga. Por lo general son aniones o neutros con electrones libres, por lo tanto, ceden electrones. Es el caso del H-, OH-, CN-, etc.
Principales tipos de reacciones orgánicas:
Si tenemos en cuenta la relación que existe entre el sustrato y los productos de la reacción, podemos distinguir diferentes tipos de reacciones orgánicas. Destacamos las reacciones de sustitución, de adición, de eliminación, de condensación, así como las reacciones de polimerización.
–Reacciones de sustitución: Son reacciones donde un átomo o varios átomos de un reactivo se meten en la cadena de carbonos que forma al sustrato, consiguiendo cambiar alguno de los átomos que se encuentran unidos al carbono.
R-X (sustrato) + Y ( reactivo) → R-Y + X
Según el tipo de ruptura que se cree en los enlaces, la sustitución podrá ser homolítica o heterolítica. La más frecuente es la sustitución heterolítica, la cual además puede ser nucleófila o electrófila (SN1, SN2, E1, o E2).
– Reacciones de adición: Se conocen como reacciones de adición a aquellas donde dos átomos que se encuentren unidos a través de enlaces dobles o triples, cuando se han roto, se unen a otros tipos de átomos a través de enlaces simples. Estas adiciones pueden ser nucleófilas o electrófilas.
– Reacciones de eliminación: Las reacciones de eliminación son en las cuales la molécula que forma el sustrato sufre una perdida de dos átomos o grupos de ellos, que se encuentran enlazados a su vez a dos átomos de carbono adjunto, formándose entre ellos un enlace tipo π. Son las reacciones contrarias a las de adición.
– Reacciones de condensación: Estas reacciones suceden cuando dos o más de las moléculas orgánicas se enlazan a través de una eliminación molecular.
–Reacciones de polimerización: Estas reacciones tienen una alta importancia en la práctica, pues dan lugar a la formación de sustancias poliméricas, es decir, moléculas con un gran tamaño, resultantes de unir muchas moléculas en una sólo, que por lo tanto será más compleja.
jueves, 1 de agosto de 2019
Semana #25
Isomeria Conformacional:
 Para representar las distintas conformaciones se utilizan las proyecciones de Newman.
Para representar las distintas conformaciones se utilizan las proyecciones de Newman.



Se denominan conformaciones las diferentes disposiciones espaciales de los átomos cuando la cadena realiza un giro cuyo eje es un enlace simple C - C.
En los alcanos pueden distinguirse tres conformaciones:
- Alternada.Es la más estable (menor energía) pues sus átomos están los más separados posible y por tanto la interacción es mínima.
- Eclipsada.Es la menos estable (mayor energía).
- Sesgada o desviada.Se llaman así a las infinitas conformaciones que existen entre la alternada y la eclipsada.Su energía es mayor que la alternada y menor que la eclipsada.
| Análisis conformacional del ciclohexano. |
La conformaciones más importantes que puede presentar el ciclohexano son la silla y el bote.Estas conformaciones experimentan una interconversión continua.La forma de silla es más estable que la de bote,por lo que la forma de silla es mayoritaria.Se estima que,en un momento dado,más del 99% de las moléculas se encuentran en forma de silla.Entre las conformaciones de silla y de bote destaca la conformación de bote torsionado de mayor estabilidad que el bote
viernes, 26 de julio de 2019
Semana #24
Isomeros ópticos:
Cuando un compuesto ópticamente activo, rota la luz polarizada en el sentido de las agujas del reloj, se dice que es dextrógiro y se representa por (+).
Son imágenes que no se pueden superponer (se dice que la imagen del isómero se puede superponer cuando la estructura se empalma con otra y coinciden todos sus lados, al igual que los geométricos, estos se presentan en pares.
Dextrogiro
Cuando un compuesto ópticamente activo, rota la luz polarizada en el sentido de las agujas del reloj, se dice que es dextrógiro y se representa por (+).
Levogiro
Las sustancias que rotan la luz en sentido contrario a las agujas del reloj, son levógiras levógiras y se representa por (-).
Proyeccion de Fisher:
Las proyecciones de Fischer son utilizadas en química orgánica para representar en dos dimensiones la disposición espacial de moléculas en las que uno o más átomos de carbono están unidos a 4 sustituyentes diferentes. Deben su nombre al químico alemán Hermann Emil Fischer.
Estos átomos pueden existir en dos configuraciones espacialmente diferentes, que son imágenes especulares (simétricas respecto a un plano) entre sí, como lo son la mano derecha de la izquierda, y al igual que éstas no son superponibles en el espacio.
Estos átomos constituyen centros quirales o de isomería espacial. Cada centro quiral da lugar a dos moléculas isómeras especulares o enantiómeros. Una molécula con 2 centros quirales puede tener 4 estereoisómeros (22 esteroisómeros, 2 parejas de enantiómeros); una con 3 centros quirales puede tener 8 estereoisómeros (23 esteroisómeros, 4 parejas de enantiómeros); y así sucesivamente.
Los estereoisómeros que posibilitan los centros quirales de una molécula son, en principio, iguales química y físicamente, salvo que al incidir sobre sus respectivas disoluciones la luz polarizada el plano de vibración de ésta gira un ángulo diferente en cada caso.
En una proyección de Fisher se representa cada carbono quiral con sus cuatro sustituyentes dispuestos en cruz aplicando la siguiente convención:
- Los sustituyentes situados a derecha e izquierda sobresalen del plano de representación (papel o pantalla) y en el espacio estarían situados por delante de dicho plano, hacia el observador.
- Los sustituyentes representados arriba y debajo del centro quiral estarían situados espacialmente detrás del átomo quiral.
- Hay que cuidar de no girar 90º la proyección de una molécula dada, porque obtendremos la representación de su enantiómero: los sustituyentes que en la primera estaban dirigidos “hacia el fondo” habrán pasado a estarlo “hacia adelante” y viceversa.
sábado, 20 de julio de 2019
Semana #23
Isomeros Geometricos:
Son estereoisomeros que no pueden convertirse uno en otro sin que se rompa un enlace química, esto se presentan en pares y utilizan los términos Cis y Trans
Son el tipo específico de diasteromeros que deben su existencia a la rotación impedida en torno del enlace carbono-carbono ( C- C )
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono.
Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans.
ISOMERO CIS
Significa que dos atomos en particulares son adyacentes que están del mismo lado del doble enlace o en la misma cara
ISOMERO TRANS
Cuando dos grupos de 2 atomos existen de lado opuesto de la formula estructural
viernes, 12 de julio de 2019
viernes, 5 de julio de 2019
Semana #21
Clasificación de isomeros:
De nuevo obsérvese como los átomos están unidos de forma distinta en ambas moléculas.
El 2-Pentanol y el 3-Pentanol son isómeros de posición. El grupo hidroxilo ocupa distinta posición en cada molécula.

En los estereoisómeros los átomos están conectados de igual manera en ambas moléculas. La diferencia radica en la distinta orientación espacial de los átomos o grupos de átomos. Los estereoisómeros se clasifican en isómeros geométricos (cis-trans), enantiómeros y diastereoisómeros.

Los isómeros son moléculas que tienen la misma fórmula molecular pero diferente estructura. Se clasifican en isómeros estructurales y estereoisómeros. Los isómeros estructurales difieren en la forma de unión de sus átomos y se clasifican en isómeros de cadena, posición y función. Como ejemplo, dibujemos los isómeros estructurales de fórmula C2H6O .


Solamente existen dos formas de unir los átomos que generan compuestos diferentes. En el etanol, el oxígeno se enlaza a un carbono y a un hidrógeno. En el dimetil éter está unido a dos carbonos. Se trata de isómeros estructurales puesto que los átomos están unidos de forma distinta en ambas moléculas. Al pertenecer a diferentes grupos funcionales (alcohol y éter) se les clasifica como isómeros de función.
Pentano y 2-Metilbutano son isómeros se cadena, ambos de fórmula C5H12. El pentano es un alcano con cadena lineal mientras que el 2-Metilbutano presenta una ramificación.

Pentano y 2-Metilbutano son isómeros se cadena, ambos de fórmula C5H12. El pentano es un alcano con cadena lineal mientras que el 2-Metilbutano presenta una ramificación.

De nuevo obsérvese como los átomos están unidos de forma distinta en ambas moléculas.
El 2-Pentanol y el 3-Pentanol son isómeros de posición. El grupo hidroxilo ocupa distinta posición en cada molécula.

En los estereoisómeros los átomos están conectados de igual manera en ambas moléculas. La diferencia radica en la distinta orientación espacial de los átomos o grupos de átomos. Los estereoisómeros se clasifican en isómeros geométricos (cis-trans), enantiómeros y diastereoisómeros.

martes, 26 de febrero de 2019
Semana 6
Hibridacion del carbono:
La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital molecular “híbrido” con características propias. La noción de orbital atómico da una mejor explicación que el concepto anterior de órbita, para establecer una aproximación de dónde hay mayor probabilidad de hallar un electrón dentro de un átomo.
Dicho de otra forma, un orbital atómico es la representación de la mecánica cuántica para dar una idea de la posición de un electrón o par de electrones en una zona determinada dentro del átomo, donde cada orbital se define de acuerdo con los valores de sus números cuánticos.

La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital molecular “híbrido” con características propias. La noción de orbital atómico da una mejor explicación que el concepto anterior de órbita, para establecer una aproximación de dónde hay mayor probabilidad de hallar un electrón dentro de un átomo.
Dicho de otra forma, un orbital atómico es la representación de la mecánica cuántica para dar una idea de la posición de un electrón o par de electrones en una zona determinada dentro del átomo, donde cada orbital se define de acuerdo con los valores de sus números cuánticos.

Los números cuánticos describen el estado de un sistema (como el del electrón dentro del átomo) en determinado momento, por medio de la energía perteneciente al electrón (n), el momento angular que describe en su movimiento (l), el momento magnético relacionado (m) y el giro del electrón mientras se desplaza dentro del átomo (s).
Estos parámetros son únicos para cada electrón en un orbital, por lo que dos electrones no pueden tener exactamente los mismos valores de los cuatro números cuánticos y cada orbital puede ser ocupado por dos electrones como máximo.
martes, 19 de febrero de 2019
Semana 5
Ejercicios de la Ley de Dalton:
1.En un recipiente de 5 L se introducen 8 g de helio, 84 g de nitrógeno diatómico y 90 g de vapor de agua. Si la temperatura del recipiente es de 27 °C, calcula:
1.En un recipiente de 5 L se introducen 8 g de helio, 84 g de nitrógeno diatómico y 90 g de vapor de agua. Si la temperatura del recipiente es de 27 °C, calcula:
a) Presión total que ejercen los gases en las paredes del recipiente.
b) La presión que ejerce cada gas.
martes, 12 de febrero de 2019
Semana 4
Ley de Dalton:
Donde p1, p2, ..., pn son las presiones parciales de cada uno de los gases de la mezcla.

La Ley de Dalton (o Ley de Proporciones Múltiples) es una ley de los gases que relaciona las presiones parciales de los gases de una mezcla.
En 1801 Dalton descubrió que:
En 1801 Dalton descubrió que:
- La presión total de una mezcla de gases es igual a la suma de las presiones que ejercen cada uno de los gases que la componen.
PTotal = p1+p2+...+pn
Donde p1, p2, ..., pn son las presiones parciales de cada uno de los gases de la mezcla.

Ejemplo:
calcular la presión de una mezcla de los siguientes gases contenidos en un recipiente de 2 litros a 100ºC:
- 20 gramos de O2
- 20 gramos de H2
- 20 gramos de CO2
- PTotal = p1+p2+...+pn = n1·R·T/V + n2·R·T/V + ... + n3·R·T/V = (R·T/V) · (n1+n2+...+nn)
- Entonces calculamos los moles de cada uno de los gases:
- 20 gramos de O2 = 20 / 32 = 0,625 moles
- 20 gramos de H2 = 20 / 2 = 10 moles
- 20 gramos de CO2 = 20 / 44 = 0,454 moles
- La suma de los moles de gases es:
- n= 0,625 +10 + 0,454 = 11,08 moles
- PTotal = (R·T/V) · (n1+n2+n3) = (0,0821 · 373 / 2) · 11,08 = 169 atmósferas
lunes, 4 de febrero de 2019
Semana 3
Ley de los gases ideales:

Lo cual tiene como consecuencia que:

Los gases ideales es una simplificación de los gases reales que se realiza para estudiarlos de manera más sencilla. En sí es un gas hipotético que considera:
- Formado por partículas puntuales sin efectos electromagnéticos.
- Las colisiones entre las moléculas y entre las moléculas y las paredes es de tipo elástica, es decir, se conserva el momento y la energía cinética.
- La energía cinética es directamente proporcional a la temperatura.
- Los gases se aproximan a un gas ideal cuando son un gas mono atómico, está a presión y temperatura ambiente.
La ecuación del gas ideal se basa condensa la ley de Boyle, la de Gay-Lussac, la de Charles y la ley de Avogadro.

Ley de Avogadro:
La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes.
En 1811 Avogadro realiza los siguientes descubrimientos:
- A presión y temperatura constantes, la misma cantidad de gas tiene el mismo volumen independientemente del elemento químico que lo forme
- El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
Lo cual tiene como consecuencia que:
- Si aumenta la cantidad de gas, aumenta el volumen
- Si disminuye la cantidad de gas, disminuye el volumen

Ejemplo:
Sean 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
- V1 / n1 = V2 / n2
- V1 = 2 litros
- n1 = 0,5 moles
- n2 = 0,5 + 1 = 1,5 moles
- V2 = V1 · n2 / n1 = 2 · 1,5 / 0,5 = 6 litros
viernes, 25 de enero de 2019
Semana 2
Ley de Boyle:
Es una ley de los gases que relaciona la presión y el volumen de una determinada cantidad de gas, sin variación de temperatura, es decir, a temperatura constante. También se la conoce como Ley de Boyle-Mariotte porque fue formulada independientemente por el físico y químico anglo-irlandés Robert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676).

Formulas:

Es una ley de los gases que relaciona la presión y el volumen de una determinada cantidad de gas, sin variación de temperatura, es decir, a temperatura constante. También se la conoce como Ley de Boyle-Mariotte porque fue formulada independientemente por el físico y químico anglo-irlandés Robert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676).
Formulas:
Esta ley se puede expresar de forma matemática como:
P · V = k
P es presión
V es Volumen
(k es una constante cuando Temperatura y masa son constantes).
P es presión
V es Volumen
(k es una constante cuando Temperatura y masa son constantes).
Esta fórmula se puede utilizar para determinar el cambio de presión o temperatura durante una transformación isotérmica de la siguiente manera:
P1 · V1 = P2 · V2
Es decir, que el producto entre la presión inicial y el volumen inicial es igual al producto de la presión final por el volumen final. Por ejemplo, si se desea determinar el volumen final, será suficiente dividir P1V1 entre P2.
(P1 · V1)/ P2 = V2
Como se puede observar en la siguiente animación, cuando aumenta la presión, el volumen baja y viceversa.

Ejemplo:
Un determinado gas con una presión de 1,8 atm ocupa un volumen de 0,9L. Manteniendo constantes
la temperatura, se aumenta la presión del gas a 4,1 atm. Calcular el volumen ocupado por el gas.
la temperatura, se aumenta la presión del gas a 4,1 atm. Calcular el volumen ocupado por el gas.
Teniendo en cuenta la fórmula de la ley de Boyle planteada anteriormente P1 · V1 = P2 · V2 se realizan los cálculos necesarios.
(P1 · V1)/ P2 = V2
(1,8atm · 0,9L)/ 4,1atm = V2 = 0,395L
Respuesta: El nuevo volumen ocupado por el gas será 0,395L
Ley de Charles:
"El volumen de una muestra de gas se expande cuando se calienta y se contrae al enfriarse."
De acuerdo con el enunciado, la ley de Charles puede expresarse matemáticamente de la siguiente manera:
V1 / T1 = K
V = volumen
T = temperatura
K = Costante
T = temperatura
K = Costante
que se puede expresar como V1 = K . T1
como se puede observar en la última fórmula, en condiciones de presión constante y número de moles constante, el volumen es directamente proporcional a la temperatura. Si la temperatura aumenta, también aumenta el volumen.
Formula:
Cuando se desean estudiar dos diferentes estados, uno inicial y una final de un gas y evaluar el cambio de volumen en función de la temperatura o viceversa, se puede utilizar la fórmula:
V1 / T1 = V2 / T2
y despejar según la incógnita que se desee resolver.
Ejemplo:
Si se tienen 0,2 litros de un gas a 30 °C y 1 atm de presión ¿Qué temperatura debería alcanzar para que aumente a 0,3 litros?
Los datos son:
V1 = 0,2L
T1 = 30 °C = 303,15 K (que se obtiene sumando 30 + 273,15)
P1 = P2 = 1 atm
V2 = o,3L
T2 = ?
T1 = 30 °C = 303,15 K (que se obtiene sumando 30 + 273,15)
P1 = P2 = 1 atm
V2 = o,3L
T2 = ?
T1 . V2 / V1 = T2(303,15 K . 0.3L) / 0,2L = T2 = 454,7 K = (454,7 – 273,15) = 181,55°C
domingo, 20 de enero de 2019
Semana 1
OBJETIVOS:
- Explicar la diversidad Biológica como consecuencia de cambios ambientales genéticos y de relación dinámica dentro de los ecosistemas.
- Relacionar la estructura de las moléculas orgánicas e inorgánicas con sus propiedades físicas y químicas y su capacidad de cambio químico.
COMPETENCIAS:
Identificar, indagar,explicar,comunicar y trabajar en equipo,disposición para aceptar naturaleza abierta parcial y cambiante del conocimiento y asumirla responsablemente.
PREGUNTAS PROBLEMATIZADORAS:
¿Cómo influye la información del ADN y el Ambiente en la diverisidad Biológica?
¿Qué variables debe tenerse en cuenta para mantener una buena salud sexual?
¿Qué variables debe tenerse en cuenta durante el registro de los cambios quimicos?
¿Por qué se utiliza neveras de icopor con hielo y acerrir para transformar sustancias que requiere
tenerse en bajas temperaturas?
¿Cómo influye la temperatura para los cambios de los cuerpos?
TEMAS:
- Configuración electronica del carbono
- Geometria molecular
- Tipos de hibraciones
- Diferencias entre formula empirica , molecular y estructural
- Fórmula Estequiometrica
- Importancia de la Quimica Orgánica
- Elementos de la quimica orgánica
- Diferencias entre compuestos orgánicos e inorgánicos
- Formas de alotropicas del carbono
- El descubrimiento de los antibioticos
- Los Hidrocarburos
EL ESTADO GASEOSO:
- Propiedades y caracteristicas de los gases
- Leyes de los gases
- Aplicaciones de los gases
- Problemas de los gases
Estado Gaseoso
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión:
|
Suscribirse a:
Comentarios (Atom)
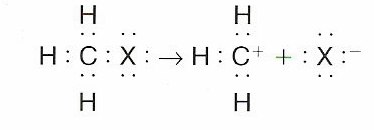
.jpg)
